2015年1月29日,一对耳聋基因携带者夫妇迎来了他们的第一个听力正常的孩子。这是我国首例经PGD联合无创产前单体型检测耳聋基因而诞生的听力健康婴儿。该病例是由解放军总医院耳鼻咽喉头颈外科王秋菊教授团队联合山东大学附属生殖医院陈子江教授团队及华大医学完成。
这个案例的意义在于它实现了聋哑防治从二、三级防控到一级预防的突破;同时,该病例治疗过程中联合使用了多项基因技术包括对遗传性耳聋进行植入前遗传诊断、以及通过母亲外周血游离DNA进行产前胎儿遗传病检测。

约60%的耳聋由遗传因素导致,另外40%与环境因素有关。已知最主要的耳聋致病基因包括GJB2、SLC26A4、GJB3与12sRNA。天津市妇女儿童保健中心的一项研究,新生儿中这几个基因的突变携带约5.52%。我国每年有3万聋儿患者出生。
该新生儿父母均为GJB2的携带者,他们已育有一名8岁的男孩为先天性耳聋患者,强烈渴望生育一个具有健康听力的孩子。
2011年3月,妻子再次怀孕,18周羊水细胞基因产前诊断结果显示胎儿也是先天性耳聋患者,夫妻忍痛引产。
2012年11月,这对夫妇来到王秋菊教授处求医,在明确夫妇双方及其聋儿的致病突变位点后,王教授请山东大学附属生殖医院的陈子江教授帮助这对夫妇实现生育健康宝宝的梦想。由于夫妇均为致病基因携带者,自然妊娠生育患儿的概率达25%,因此陈教授建议通过目前最先进的PGD技术来实现目标。当时我国尚无耳聋患者PGD成功的病例报道。

陈教授团队经过技术攻关,2014年3月,1枚PGD诊断正常的胚胎被移植入母体内。在确定成功妊娠后,王教授团队通过目前先进的无创产前单体型分析胎儿的基因型,并对羊水细胞的基因进行了验证,显示胎儿是个健康的宝宝。随后的新生儿听力筛查结果也显示宝宝的听力正常。
【案例2概况】时间回到去年,2014年9月19日,世界首例经MALBAC基因组扩增高通量测序进行单基因遗传病筛查的试管婴儿在北京大学第三医院诞生。参与机构包括北京大学第三医院乔杰教授团队、北京大学生物动态光学成像中心的谢晓亮教授团队以及汤富酬教授团队。
该案例的意义在于将一种新型的多重退火成环循环扩增技术(MultipleAnnealingandLooping-BasedAmplificationCycles,即MALBAC)应用于植入前遗传病致病基因检测,能够更好的对微量胚胎基因组DNA进行有效扩增,从而实现准确检测。
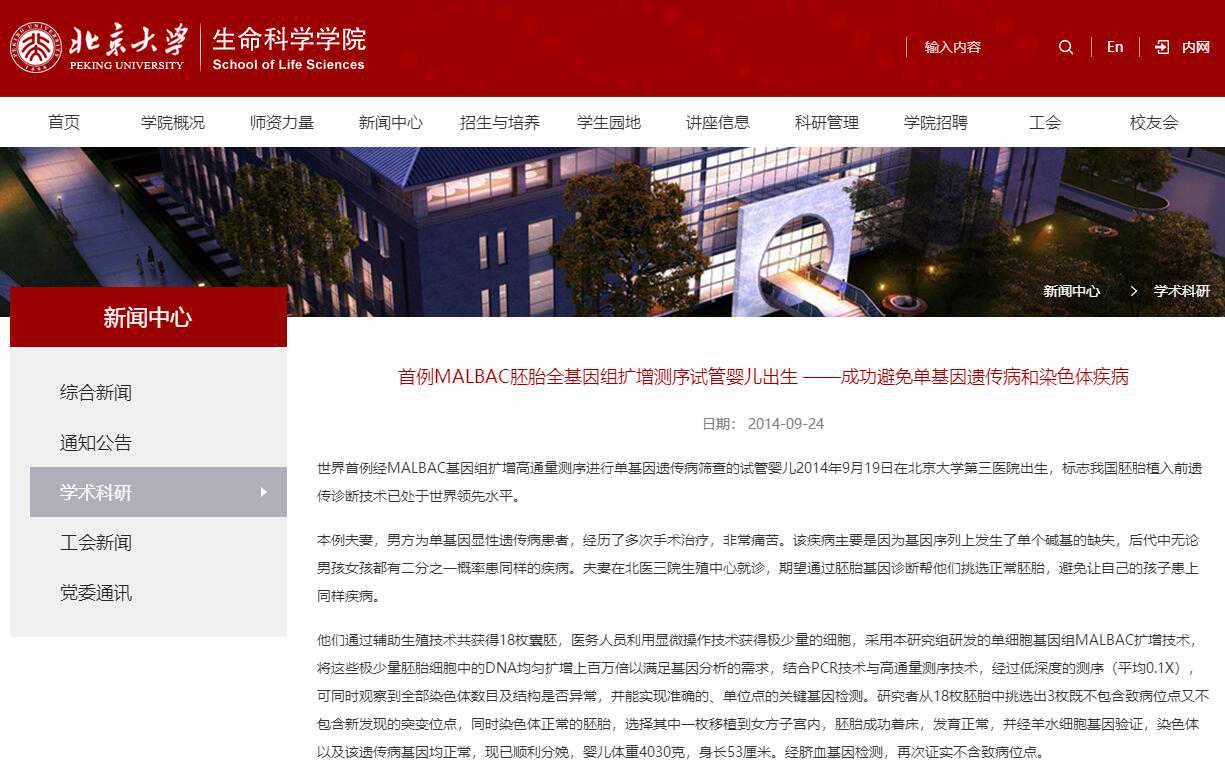
这名婴儿的父亲为单基因显性遗传病患者。该疾病主要是因为基因序列上发生了单个碱基的缺失,后代中无论男、女均有50%的概率罹患同样疾病。为能够拥有一个健康的宝宝,这对夫妇于2013年5月到北医三院生殖医学中心就诊。
通过辅助生殖技术,首先获得了18枚质量好的胚胎。采用单细胞基因组MALBAC扩增技术,将这些胚胎细胞中的少量DNA均匀扩增,结合高通量测序技术,可在检测染色体数目及结构异常的同时实现致病基因的准确检测。
2013年12月29日,1枚检测正常的胚胎被移植到母体内并成功着床。经羊水细胞基因验证,染色体以及该遗传病基因均正常。孩子出生后的遗传检测再次证实新生儿健康。
随后,2014年11月30日,第二位MALBAC宝宝也在该医院诞生了。MALBAC由谢晓亮教授团队发明。该技术采用了线性扩增,相比普通扩增技术,可以较好的降低微量初始模板扩增中产生的偏倚。
此前,以上团队应用这一技术开展了人类单精子重组研究,其成果于2012年12月发表在Science上。2013年,研究者利用这一技术又完成了单个卵细胞的高精度全基因组测序分析,可以同时检测染色体异常与遗传DNA变异,其成果发表在Cell上。
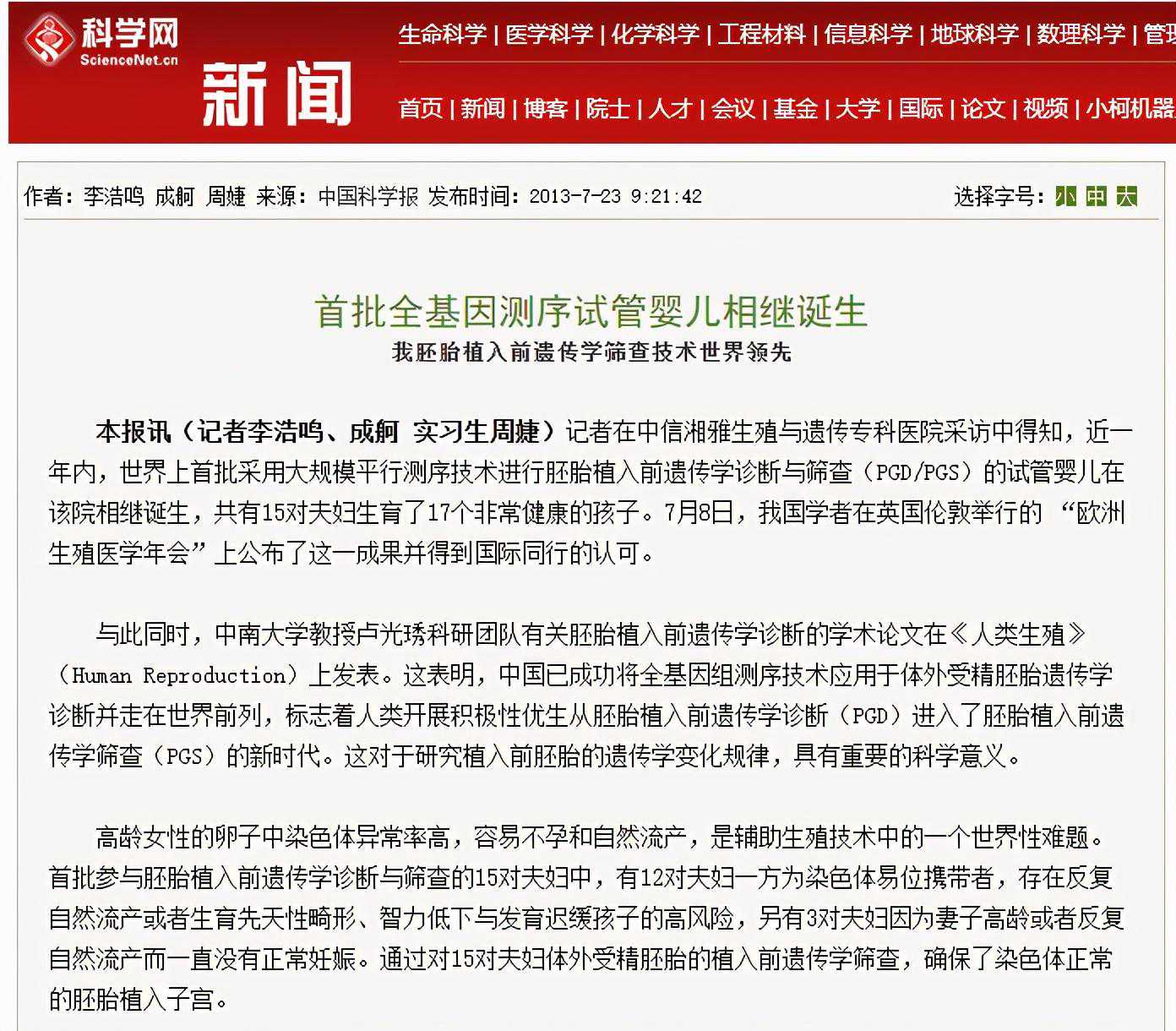
【案例3概况】2012年8月24日,首例接受全基因组测序技术筛查的试管宝宝在湖南健康出生了。相关工作由中信湘雅生殖与遗传专科医院卢光琇教授团队、人类干细胞国家工程研究中心及华大医学合作完成。这个案例标志着高通量测序技术开始应用于PGS/PGD。

高龄孕妇的卵子中染色体异常率高,容易不孕和自然流产,是辅助生殖技术中的难题。研究团队将全基因组测序技术应用于体外受精获得的胚胎染色体异常分析。该宝宝母亲妊娠前,研究人员对体外发育至第五天的7个囊胚取样,待检细胞内的遗传物质经高通量测序分析,其中3个胚胎鉴定为染色体核型正常。医生选择2个正常的胚胎进行植入,宝宝的母亲顺利单胎妊娠。孩子出生后各项发育指标正常。
包括这位宝宝的父母在内,首批参与全基因组测序技术筛查的共有15对夫妇,其中有12对夫妇一方为染色体易位携带者,发生反复自然流产或者生育先天性畸形、智力低下与发育迟缓孩子的风险较高;另有3对夫妇因为妻子高龄或者反复自然流产而一直没有正常妊娠。
通过对15对夫妇体外受精胚胎的植入前遗传学筛查,确保了染色体正常的胚胎植入子宫。自2010年开始,卢教授团队已为33对夫妇进行胚胎移植,成功妊娠的夫妇为22例,成功率为66.7%。到2013年7月22日新闻报导时,已有17名健康宝宝出生。
此后,研究团队还进一步评估了高通量测序应用于PGS/PGD的临床结局,主要评估指标包括妊娠成功率、持续妊娠率、流产率以及移植成功率等。结果显示,高通量测序结合囊胚活检以及胚胎冷冻技术,可有效应用于PGD/PGS,其结果与SNP微阵列检测无显著差异。相关研究于2014年12月发表。
【一个小插曲】2013年7月8日,研究团队在英国伦敦的第29届“欧洲人类生殖与胚胎学会(ESHRE)”上公布了上述成果。在我国学者大会发言后,英国同行也公布了一例接受全基因组测序技术筛查的试管婴儿。关于谁是第一,西方同行显然忽视了我国学者的报告。

华大外籍专家GáborVajta教授代表研究团队及时与会议方及英国同行进行了沟通,我们的成果最终得到了认可。从英国参会回来后,研究团队在当月召开了新闻发布会,正式公布我国这一进展;GáborVajta教授也和大家分享了这段不寻常的经历。一争高下并非目的。我国学者近年来在生命科学很多领域走到了前列,这些努力应当得到尊重。正如Gábor教授所言:“这是尊严问题。”
【案例4概况】2012年6月29日,我国首个通过PGD技术进行β-地中海贫血诊断、并同时进行白细胞抗原系统(HLA)配型的健康婴儿出生,标志着“治疗性试管婴儿技术”获得成功。这项工作由中山大学附属第一医院周灿权教授与余艳文教授团队完成。华大医学团队承担了单细胞HLA分型以及单细胞全基因组测序技术的研发工作。
【背景信息】地中海贫血(简称地贫)是一种常染色体隐性遗传病,由于珠蛋白基因缺失或突变而引起的一组溶血性贫血,包括α与β-地贫。地贫是我国南方地区发病率最高,影响最大的遗传病之一。重度β-地贫患者需要长期输血以维持生命,造血干细胞移植是当前根治本病的唯一方法。
一对β-地贫携带者夫妇,育有一名14岁的女儿为重度β-地贫患者。由于经常接受输血治疗,孩子因铁沉着导致胰腺功能异常并发糖尿病。此后妻子先后怀孕3次,但经产前诊断均为重度β-地贫患胎(孕中期经过羊水产前诊断)而终止妊娠。为生育一个健康孩子,同时为了救助大女儿,这对夫妇决定接受植入前遗传学诊断。
2011年,医院成功研发了对β-地贫与HLA配型同时进行诊断的技术。这对夫妇成为实施该项技术的首批患者,并最终生下一名健康女婴;在孩子出生的同时,医务人员采集了胎儿的脐带血,其中的造血干细胞可以为罹患重度β-地贫的姐姐带来重生的希望。
上述案例中的PGD,主要采用PCR反向斑点杂交进行β-地贫基因诊断,STR连锁分析进行HLA分型。随着单细胞全基因组测序技术发展,研究团队开始探索将这一新技术应用于PGS/PGD。

在2015年4月发表的一项回顾性研究中,研究人员开发了一种新型单细胞全基因组分析方法,使用自主开发的All-in-One定制芯片,可对基因组上181.37Mb的目标区域DNA(包括外显子区、标签SNP、MHC全长以及若干遗传病致病基因)进行捕获测序,在提高准确度的同时降低检测成本。
使用该方法,研究团队对上述β-地贫携带者夫妇、其患重度地贫的大女儿的外周血DNA标本,以及剩余的胚胎单个卵裂球基因扩增产物,进行基因组捕获测序,能够在对胚胎进行地贫基因诊断的同时,获得HLA基因型以及胚胎染色体非整倍体信息。

大家了解到的这几个新技术的成功应用案例,是近几年科技进展的一个缩影,但并不意味着新技术能解决所有的医学问题;新技术自身及其如何合理规范的应用于临床,还有很多工作要做;同时也会带来诸如伦理学等多方面的挑战(这些重要内容留待以后探讨)。
临床上每一个案例都是重要而独特的,对患者如此,对医者亦如此。然而新的进展总是令人鼓舞,因为如果应用得当,它就有可能服务于实践并为部分患者及其家庭带来希望!
谨祝愿人人健康,家家幸福!